@ -4,13 +4,17 @@
\section { Stabilizzazione meccanica}
\label { sec:stabilization}
Nonostante l'isolamento meccanico fornito dagli elastomeri e dal
tavolo ottico la posizione del campione rispetto al centro
dell'obiettivo e la quota del piano focale sono soggette a
fluttuazioni e derive.
L'isolamento meccanico fornito dagli elastomeri e dal
tavolo ottico non è sufficiente a
mantenere la posizione del campione stabile al livello di precisione
del nanometro, precludendo la possibilità di poter eseguire misurazioni
di forza con la sensibilità del $ \pN $ .
Gli effetti più evidenti e rilevabili sono rapide oscillazioni della
posizione del campione dovute a vibrazioni acustiche residue e una
progressive deriva rispetto alla posizione fissata che diventa
posizione del campione dovute a vibrazioni acustiche residue e, quando
queste non vengono corrette, una
progressiva deriva rispetto alla posizione fissata che diventa
significativa ($ > \SI { 100 } { \nm } $ ) per tempi di osservazione di
diversi minuti.
@ -19,7 +23,7 @@ diverse microsfere in silice, di diametro \SI{0.5}{\um}, vengono
immobilizzate in uno strato di nitrocellulosa depositato nella
superficie interna del vetrino coprioggetti.
Le varie fasi per la preparazione di questo campione sono descritte
nei particolari nell'appendice \ref { app:protocols} , protocollo
in dettaglio nell'appendice \ref { app:protocols} , protocollo
\ref { proto:silica_ beads_ flow_ cell} .
Le microsfere immobilizzate nel campione possono essere messe a fuoco
@ -42,9 +46,9 @@ si sceglie di effettuare il calcolo del centroide limitando la regione
dell'immagine utilizzata a un rettangolo nel quale una microsfera è
sufficientemente isolata.
Ricalcolando il centroide intervalli temporali fissati è possibile
Ricalcolando il centroide a intervalli temporali fissati è possibile
osservare la deriva della posizione (x, y) della microsfera.
Inoltre è possibile sfruttare questo stesso campione per effettuare
Inoltre si ha la possibilità sfruttare questo stesso campione per effettuare
una calibrazione del fattore di conversione pixel/nm lungo due assi
ortogonali.
@ -56,23 +60,23 @@ centroide si ottiene il rapporto tra lo spostamento comandato al
traslatore (in \si { \nm } ) e la variazione del centroide (in pixel).
Ripetendo questa operazione in sequenza per vari punti si ottiene
una curva di calibrazione per l'asse scansionata, dalla quale è
possibile estratt e la costante di proporzionalità con un \textit { fit}
possibile estrarr e la costante di proporzionalità con un \textit { fit}
lineare.
Risulta più complesso invece stimare la deriva del piano focale:
per questo motivo è stato sviluppato un metodo per determinare a
partire dalle immagini un valore che sia linearmente proporzionale
per questo motivo è stato sviluppato un metodo per determinare, a
partire dalle immagini, un valore che sia linearmente proporzionale
alla quota del piano focale rispetto al centro della sfera.
Il metodo sviluppato sfrutta le caratteristiche dalla distribuzione
radiale della luce diffusa dalla microsfera.
In figura \ref { fig:radial_ itensity} rappresentato l'andamento del
profilo radiale variando la quota del piano focale (z).
In figura \ref { fig:radial_ itensity} è rappresentato l'andamento del
profilo radiale che si ottiene variando la quota del piano focale (z).
\begin { figure} [ht]
\centering
\includegraphics { images/radial_ intensity.pdf}
\caption { Profilo di ind ensità radiale rispetto al centroide
\caption { Profilo di int ensità radiale rispetto al centroide
per una microsfera, in diversi piani }
\label { fig:radial_ itensity}
\end { figure}
@ -80,10 +84,10 @@ Da questi dati è stato possibile osservare che il rapporto tra
l'intensità integrata in un anello centrato sulla microsfera e quella
integrata nella regione interna al medesimo anello (regioni gialle
e arancioni in figura), mostra un andamento proporzionale alla quota
del piano focale, almeno in un certo intorno del centro della sfera.
del piano focale in un certo intorno del centro della sfera.
In figura \ref { fig:z_ est} viene mostrato l'andamento del rapporto
tra l'intensità media in un anello con raggio interno ed esterno
tra l'intensità media in un anello con raggi interno ed esterno
rispettivamente di \SIlist { 80;160} { pixel} e l'intensità media
calcolata in un raggio di \SI { 60} { pixel} .
@ -98,16 +102,17 @@ calcolata in un raggio di \SI{60}{pixel}.
Come si può osservare la quantità così definita può essere usata
per determinare la quota con una discreta sensibilità in
un intervallo di \SIrange { 3} { 4} { \um } intorno al centro della sfera.
Analogamente a quanto fatto per le assi x e y è possibile eseguire
Analogamente a quanto fatto per gli assi x e y è possibile eseguire
una calibrazione spostando il campione di una quota controllata
attraverso il traslatore piezoelettrico dell'obiettivo, e costruire
una curva di calibrazione come quella in figura \ref { fig:z_ est} .
Conoscendo quindi tre fattori di calibrazione è possibile, partendo
da un'immagine della microsfera, ottenere una stima della sua
posizione nello spazio tridimensionale. Questo fatto ci permette
posizione nello spazio tridimensionale. Questo ci permette
di implementare un sistema attivo di stabilizzazione meccanica del
microscopio. Continuando a monitorare la sfera mediante mentre si
microscopio. Continuando a monitorare la sfera, mediante l'illuminazione
a luce trasmessa, mentre si
eseguono le misurazioni di forza è possibile rilevare gli spostamenti
del campione e compensarli inviando appositi comandi ai traslatori
piezoelettrici.
@ -122,18 +127,15 @@ attivata, il codice acquisice diverse immagini della microsfera e
ne stima la posizione iniziale in termini di coordinate (x, y, z),
usando i fattori di conversione determinati con la calibrazione.
A questo punto viene avviato un ciclo di retroazione: continuando
a acquisire immagini della microsfera (a una frequenza che può
ad acquisire immagini della microsfera (a una frequenza che può
arrivare fino a \SI { 100} { \Hz } ), viene comandato ai traslatori
uno spostamento proporzionale alla differenza tra la posizione della
sfera rilevata e quella iniziale.
Quando il sistema di stabilizzazione meccanica viene attivato
è stato possibile mostrare che la posizione media del campione resta
stabile indipendentemente dal tempo di osservazione, con fluttuazione
stabile indipendentemente dal tempo di osservazione, con fluttuazioni
che hanno una deviazione standard di circa \SI { 1} { \nm } .
Introdurre nel ciclo di controlla alla componente proporzionale
una componente integrale o derivativa non altera significativamente
la stabilizzazione raggiunta.
Il fattore di proporzionalità del ciclo di retroazione
(guadagno, $ g $ ) influenza
le caratteristiche della risposta del sistema: un fattore troppo
@ -158,9 +160,9 @@ del fattore di proporzionalità $g$.
L'acquisizione di diverse tracce della durata di 5-10 minuti ha
sempre mostrato deviazioni standard delle fluttuazioni comprese
tra \SIlist { 1;2} { \nm } .
In figura \ref { fig:active_ stab} vengono riporati i tracciati delle
In figura \ref { fig:active_ stab} vengono riport ati i tracciati delle
fluttuazioni della posizione del campione, con (nero) e senza
(rosso) l'intervend o del sistema di stabilizzazione attiva.
(rosso) l'intervent o del sistema di stabilizzazione attiva.
\begin { figure} [ht]
\centering
@ -171,13 +173,13 @@ fluttuazioni della posizione del campione, con (nero) e senza
\end { figure}
\section { Calibrazione parametri trappole}
\section { Calibrazione dei parametri delle trappole}
\label { sec:calibration}
Per poter eseguire misurazioni di forza su sistemi biologici è
fondamentale riuscire a conoscere il valore della tensione applicata
alle microsfere intrappolate nelle pinzette ottiche. Questo è
possibile dal momento che l'azione di una pinzetta ottica su una
alle microsfere intrappolate nelle pinzette ottiche. Questo si può
effettuare poriché l'azione di una pinzetta ottica su una
microsfera può essere modellizzata come una forza di richiamo
elastica (vedi sezione \ref { sec:ot} ).
@ -188,7 +190,7 @@ fluttuazioni della posizione del campione, con (nero) e senza
Quando la microsfera viene messa in movimento da una forza esterna,
è necessario considerare anche l'attrito viscoso con
il fluido in cui è immersa. La forza dovuto all'attrito viscoso
il fluido in cui è immersa. La forza dovuta all'attrito viscoso
avrà la forma:
\begin { equation}
\vec { F} _ { visc} = - \gamma \vec { v} \
@ -197,7 +199,7 @@ fluttuazioni della posizione del campione, con (nero) e senza
Dove $ \gamma $ è il coefficiente di attrito idrodinamico della
microsfera.
Nel caso più genere le la microsfera sarà inoltre soggetta a una
Nel caso più genera le la microsfera sarà inoltre soggetta a una
sforza stocastica ($ \eta ( t ) $ ), dovuta agli urti con il fluido, e
a una forza esterna $ \vec { F } $ , ad esempio dovuta alle tensione di una
biomolecola legata ad essa.
@ -648,15 +650,89 @@ prestazioni del sistema utilizziamo dei campioni in cui una distribuzione
di Alexa 647 è immobilizzata sul vetrino coprioggetti (vedi appendice
\ref { app:protocols} , protocollo \ref { proto:alexa} ).
\begin { figure} [ht]
\centering
\includegraphics { images/alexa647.png}
\caption { Caption}
\label { fig:my_ label}
\includegraphics [scale=0.8] { images/alexa647.png}
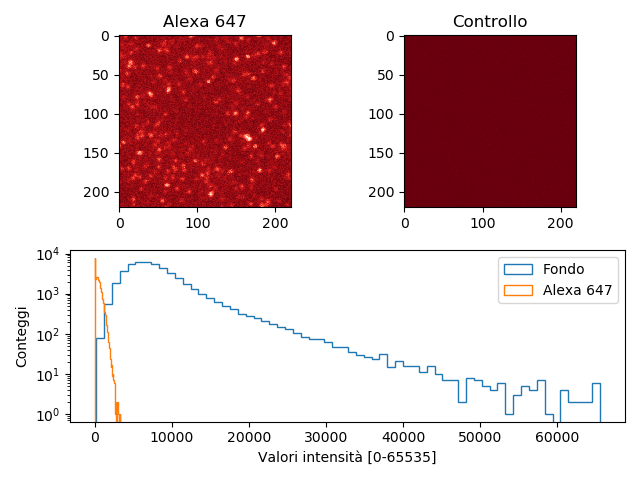
\caption { Cella di flusso con fluorofori immobilizzati sul vetrino coprioggetti (a sinistra) e campione di controllo senza fluorofori (a destra). Istogramma delle due
immagini (in basso).}
\label { fig:alexa647}
\end { figure}
Il contrasto medio tra i fluorofori è lo sfondo (media dell'intensità in una regione
lontana dai fluorofori) è maggiore di 10.
\begin { figure}
\centering
\includegraphics [scale=0.8] { images/snr.png}
\caption { Profilo di intensità della PSF di un fluoroforo.}
\label { fig:snr}
\end { figure}
\section { TIRF e illuminazione a modi di galleria}
\label { sec:gallery_ mode}
Quando sono presenti fluorofori liberi in soluzione, per esempio nel caso
in cui si voglia studiare l'interazione delle due proteine sottoposte a
\textit { force-clamp} con una terza piccola molecola marcata,
il rapporto segnale-rumore si riduce drasticamente.
La fluorescenza fuori fuoco infatti farà aumentare il valore medio del rumore
di fondo, arrivando a nascondere il segnale dei singoli fluorofori sul
piano focale.
Come è stato introdotto in \ref { sec:fluo} è possibile migliorare il rapporto
segnale/rumore in questi casi sfruttando schemi di illuminazione che riducono
il volume di campione eccitato.
Nel nostro caso l'interesse sta non solo nel ridurre il volume di eccitazione,
ma concentrarlo in una regione di poche centinaia di \si { \nm } intorno al sito
di interazione tra le due proteine sottoposte a \textit { force-clamp} .
Grazie all'utilizzo dello specchio mobile sul percorso di eccitazione della
fluorescenza, e di un obiettivo TIRF, è possibile esplorare tramite questo
apparato due possibili scenari sperimentali per rilevare la fluorescenza
nei dintorni della regione del legame.
Il primo schema (figura \ref { fig:gallery_ tirf} ) fa leva sull'accoppiamento evanescente
tra l'onda elettromagnetica presente sulla superficie del vetrino (illuminazione
TIRF) e i modi di galleria della microsfera immobilizzata (che si comporta come
risuonatore ottico). In questo modo un fluoroforo che si viene a trovare molto
vicino alla microsfera potrà acquisire, sempre per accoppiamento evanescente, parte
della radiazione luminosa immagazzinata nei modi di galleria.
Il secondo schema (figura \ref { fig:gallery_ hilo} ) sfrutta invece uno schema di
illuminazione HILO nel quale la microsfera è raggiunta lateralmente dal fascio di
eccitazione.
In questo modo è possibile eccitare direttamente i fluorofori (senza dipendere
dall'accoppiamento evanescente) quando questi non vengono messi in ombra dalla
microsfera. Quando si trovano sul lato opposto una loro eccitazione potrebbe comunque
essere resa possibile dalla luce diffusa attraverso la microsfera.
Un possibile problema di questo schema riguarda la geometria imposta dalla disposizione
degli elementi ottici: il fascio inclinato infatti raggiunge il campione dallo stesso
lato delle trappole. In queste condizioni, specialmente all'aumentare della potenza del
laser usato per la fluorescenza, potrebbe diventare significativo l'effetto della pressione
di radiazione del fascio obliquo sulle microsfere intrappolate, variando la dinamica delle
loro fluttuazioni e quindi influenzando la corretta esecuzione del \textit { force-clamp} .
\begin { figure} [h]
\centering
\begin { subfigure} { 0.45\linewidth }
\centering
\includegraphics [width=\linewidth] { images/gallery_ tirf.pdf}
\caption { }
\label { fig:gallery_ tirf}
\end { subfigure}
\hfill
\begin { subfigure} [H]{ 0.45\linewidth }
\centering
\includegraphics [width=\linewidth] { images/gallery_ hilo.pdf}
\caption { }
\label { fig:gallery_ hilo}
\end { subfigure}
\centering
\caption { Ipotesi di esperimenti con fluorescenza di singola molecola combinata a \textit { force-clamp} e schema di illuminazione
TIRF (a) e HILO (b).}
\label { fig:three_ beads}
\end { figure}
 overleaf
overleaf